Transmutation 55Mn
+
1H :=: 56Fe ?
oder
Eine Anregung, wie man es nicht machen sollte
Edwin Engel, Rudolf Gruber
verfasst Januar 2006,
ergänzt November 2006
Im Buch „Biological Transmutations“ von Prof. Louis Kevran sind Experimente von Prof. Pierre Baranger (Leiter des Laboratoriums für Oeganische Chemie an der Ecole Polytechnique Paris) beschrieben, die gezeigt haben, dass Leguminosen bei der Keimung Mangan in Eisen umwandeln können. Das nachfolgende Experiment ist ein Versuch, diese Ergebnisse zu reproduzieren.
Experiment mit Mungobohnen
Herstellung von 250ml einer Mn-Lösung (750mg/l), die zur Keimung der Mungobohnen verwendet wird:
MnCl2x4H2O MW = 197,91g/mol
Mn MW = 54,94g/mol
197,91/54,94 = 3.6023
750mg/1000ml Mn = 187.5mg/250ml
187,5mg Mn x 3,60229 = 675.43mg MnCl2x4H2O
675mg MnCl2x4H2O werden mit Leitungswasser auf 250ml aufgefüllt
Wasserprüfung durch Agrolab (verwendetes Leitungswasser)
Eisen: <0,01 mg/l
Mangan: <0,005 mg/l
Isotope: Vorkommen in der Natur
25Mn55 100% 25p, 30n
26Fe56 91,66% 26p, 30n
Um von 25Mn55 auf 26Fe56 zu kommen muss man je ein Proton und Elektron hinzufügen, also ein Wasserstoffatom (Protium 1H1).
Experiment: 30g (Trockengewicht) Mungobohnen + Mn-Lösung sollen zur Keimung gebracht werden
Kontrolle: 30g (Trockengewicht) Mungobohnen ohne Keimung
Die Mungobohnen werden 2 Wochen lang bei Raumtemperatur (offen stehen lassen) gekeimt, dabei wird je nach Bedarf die Mn-Lösung zugegeben:

Beide Bohnenproben werden bei 80°C in Porzellantiegeln getrocknet. Dabei wird bei der Kontrolle die gleiche Menge an Mn-Lösung wie bei den gekeimten Bohnen (125ml) mit eingetrocknet.
Photometrische Eisenbestimmung:

nicht gekeimt gekeimt
1. Prinzip:
Das nicht in Form von FeII-Ionen vorliegende Fe wird nach dem Lösen mit Hydroxylammoniumchlorid in FeII-Ionen überführt. Die FeII-Ionen werden nach Umsetzung mit 1,10-Phenanthrolin zu einem orangeroten Komplex bei 508 nm photometrisch bestimmt.
2. Störungen:
- Kupfer, Cobalt, Chrom, Zink, Phosphat stören bei einer
10-fachen Konzentration der des Eisens.
- > 2 mg/l beim Nickel
- > 1 mg/l bei Bismut, Silber und Quecksilber
- > 50 mg/l bei Cadmium
3. Chemikalien:
0,5 %ige 1,10 Phenanthrolin-Lsg. (beim Lösen erhitzen)
25
%ige KOH
10 %ige Hydroxylammoniumchlorid-Lsg.
1:1
HCl
Na-Acetat-Eisessiggemisch (40 g Na-Acetat, 50 ml Eisessig auf
100 ml
mit dest H2O auffüllen)
Fe-Standard (1000 mg/l)
4. Geräte:
Photometer + Zubehör
Pipetten (2,5,10,20)
Meßkolben (50 ml, 100 ml)
Waage (0,01g; 0,0001 g)
Muffelofen, Bunsenbrenner
Tiegel
(groß)
Exsikkator
5. Durchführung:
- ca. 30 - 60 g (EW) der Probe in einen mit HCl (1:1) gespülten, ausgeglühten Tiegel einwägen
- vorveraschen
-
im Muffelofen bei >550 grd C veraschen (so lange veraschen bis die Asche weiß ist)
- im Exsikkator abkühlen
- Asche im HCl (1:1) aufnehmen und
einige Minuten aufkochen lassen
- 5 ml Na-Acetat-Eisessiggemisch
in den Tiegel zugeben
- mit KOH 25 %ig den pH-Wert auf 3,4 - 5,5
einstellen
- in einen 100 ml Meßkolben überführen
-
2 ml Hydroxylammoniumchlorid-Lsg. zugeben
Fe-Bestimmung-photometrisch
- 2 ml
Phenanthrolin-Lsg. zugeben und auf 100 ml auffüllen
-
mind. 15 Min. Reaktionszeit abwarten
- Extinktion bei 508 nm
gegen einen Reagenzblindwert messen
- Standards für die
Erstellung einer Auswertungskurve
Ausgangsstandard: 1000 mg
Fe/l
Verdünnungsreihe: 5 ppm, 2 ppm, 1 ppm; 0,5 ppm;
0,2 ppm
5 ml (1000 ppm) auf
100 ml -> 50 ppm
10 ml (50 ppm) auf 100 ml -> 5 ppm
(1. Standard)
4 ml (50 ppm) auf 100 ml -> 2 ppm (2.
Standard)
10 ml (5 ppm) auf 100 ml -> 0,5 ppm (3.
Standard)
20 ml (5 ppm) auf 100 ml -> 1 ppm (4.
Standard)
4 ml (5 ppm) auf 100 ml -> 0,2 ppm (5.
Standard)
bevor die 5
Standards aufgefüllt werden
wird 5 ml
Na-Acetat-Eisessiggemisch
2 ml
Hydroxylammoniumchlorid-Lsg.
2 ml Phenanthrolin-Lsg.
zugegeben
danach wird
aufgefüllt und die Extinktion nach 15 Min. Reaktionszeit gemessen.
6. Berechnung:
Anhand der Auswertungskurve wird der Gehalt an ppm Fe abgelesen und mit
der Einwaage (EW) umgerechnet.
ppm abgelesen . 100
ppm Fe/S = --------------------------------
EW
Standard - Eichreihe
Eisenbestimmung (nicht gekeimt):
|
Einwaage Probe |
30.0000 |
g |
|
|
Extinktion (508nm) Probe |
0.0840 |
|
|
|
Wassergehalt |
0.0 |
% |
|
|
Trockensubstanz |
100.0 |
% |
|
|
Conc. In definierter Probe |
0.129 |
ppm |
|
|
Eisen / S |
0.43 |
ppm |
|
|
Eisen / TS |
0.43 |
ppm |
|
Eisenbestimmung (gekeimt):
|
Einwaage Probe |
30.0000 |
g |
|
|
Extinktion (508nm) Probe |
0.2340 |
|
|
|
Wassergehalt |
0.0 |
% |
|
|
Trockensubstanz |
100.0 |
% |
|
|
Conc. In definierter Probe |
0.929 |
ppm |
|
|
Eisen / S |
3.1 |
ppm |
|
|
Eisen / TS |
3.1 |
ppm |
|
Berechnung der Messungen:
Veraschte Proben sind bei Photometermessungen auf 100ml aufgefüllt
Extinktion:
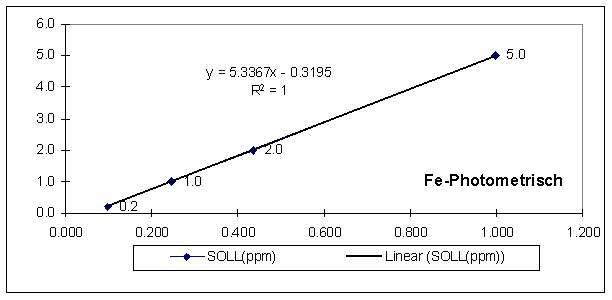
ungekeimt: 0,084 y = 5,3367x – 0,3195 0,129 ppm
gekeimt: 0,234 y = 5,3367x – 0,3195 0,929 ppm
Umrechnung mit der Einwaage:
ppm
Fe/S = ppm abgelesen x 100
Einwaage
ungekeimt: 0,129 x
100 = 0.43 ppm (mg/kg)
30
gekeimt: 0,929
x 100 = 3.1 ppm (mg/kg)
30
Absolute Gesamtmenge für 30g Mungobohnen ungekeimt: 12,9 µg Fe
Absolute Gesamtmenge für 30g Mungobohnen gekeimt: 92,9 µg Fe
Der Fe-Wert steigt auf das 7,2 fache!
2. Experiment mit Mungobohnen
Je 30g Mungobohnen werden für Kontrolle und Experiment abgewogen. Herstellung der Mn-Lösung wie zuvor:
675mg
MnCl2x4H2O werden mit Leitungswasser auf 250ml
aufgefüllt
Diesmal wird die Lösung gleich in die Porzellanschalen gegeben um zu vermeiden, dass in der Glasflasche etwas ausfällt.
Kontrolle: 125 ml
Mn-Lösung werden in der Porzellanschale bei 80°C
eingetrocknet und 30g Mungobohnen aufbewahrt
Experiment: Zu 30g Mungobohnen werden 50ml der Mn-Lösung gegeben und 75ml Mn-Lösung in Porzellanschale gegeben und bei 4°C aufbewahrt für späteres Nachgiessen (Schale wird mit Parafilm abgedeckt)
Sowohl die ungekeimten als auch die zu keimenden Bohnen werden offen stehen gelassen.
Messung: Extinktion bei 508nm
ungekeimt 0,051 >> ~ 0,2 ppm (ausserhalb der Eichgerade)
gekeimt 0,210 >> 3,0 ppm
Auch beim zweiten Versuch ist der Fe-Wert um ein Vielfaches angestiegen!

nicht
gekeimt
gekeimt
Zusammenfassung der Experimente
| Mungobohnen | Eisenwerte | Mungobohen | Eisenwerte | |
| 1. |
Ungekeimt + MnCl2 | 0,43 ppm | gekeimt + MnCl2 | 3,1 ppm |
| 2. |
Ungekeimt + MnCl2 | 0,2 ppm | gekeimt + MnCl2 | 3,0 ppm |
| 3. |
Ungekeimt + MnCl2 | 0,5 ppm | gekeimt + MnCl2 | 2,8 ppm |
| Ungekeimt - MnCl2 | 5,1 ppm | gekeimt - MnCl2 | 4,2 ppm |
Wir haben im ganzen drei Versuche durchgeführt, die gezeigt haben, dass die Werte für Eisen bei den gekeimten Bohnen um ein Vielfaches höher waren als bei den ungekeimten Proben. Sowohl bei den gekeimten als auch bei den ungekeimten Proben wurde eine MnCl2-Lösung verwendet, wobei wir die Lösung bei den ungekeimten Proben einfach im Porzellantiegel eingetrocknet haben. Soweit waren die Versuche also sehr ermutigend und wir nahmen an, dass tatsächlich eine Transmutation von Mangan zu Eisen stattgefunden hätte.
Beim dritten Versuch haben wir zur Kontrolle aber auch noch zwei Ansätze ohne Mangansalzlösung gemacht. Dabei hat sich herausgestellt, dass der Eisenwert bei den ungekeimten Bohnen (ohne Mangansalz) höher war als bei allen drei Versuchen mit gekeimten Bohnen (mit Mangansalz).
Versuch einer Erklärung:
Die Mangansalzlösung verhält sich bei der Analyse verschieden, je nachdem ob sie zuvor von den Bohnen aufgenommen wurde oder nur in den Porzellantiegeln eingetrocknet wurde. Nachträglich ist uns nämlich aufgefallen, dass sich nach dem Veraschen der Proben ein unlöslicher Rückstand bei jenen Proben gebildet hatte, wo die Mangansalzlösung nur eingetrocknet wurde, nicht jedoch bei den gekeimten Proben, die die Mangansalzlösung zuvor aufgenommen hatten. Es könnte also eine unlöslicher Eisenkomplex (bzw. auch mit Braunstein) entstanden sein, der bei der Filtration hängenblieb und deshalb die Eisenwerte bei der Farbreaktion geringer ausfielen als bei den Proben mit den gekeimten Bohnen.
Also kann man abschliessend sagen, dass diese Bestimmungsmethode nicht angemessen ist um eine Transmutation nachzuweisen.
Die Existenz der biologischen Transmutation in der Natur ist deshalb natürlich nicht in Frage gestellt, es konnte einfach nur gezeigt werden, dass die von uns gewählte Methode nicht geeignet war um diese Frage zu beantworten.
Versuche
durchgeführt im Oktober/November 2005, publiziert im Januar
2006, ergänzt im November 2006
Quelle:
www.kervran-info.de/engrub.htm